Forfait Innovation
Nature de financement
Expérimentation
Bénéficiaire
Fabricant DM
Contexte d'utilisation
Etablissement
Objectif du dispositif
Ce forfait permet à la fois :
- aux patients de bénéficier d’une technologie prometteuse,
- aux pouvoirs publics de s’assurer que la mise en place d’une étude clinique ou médico-économique va permettre de confirmer le bénéfice pour les patients ou l’intérêt en termes de réduction des coûts de la prise en charge,
- à l’entreprise d’obtenir la prise en charge financière de la technologie dès la mise en place de l’étude clinique qui établira la preuve de son efficacité.
Enjeu
Le forfait innovation est un dispositif de financement temporaire d’une technologie, conditionné à la réalisation d’une étude devant fournir des données cliniques ou médico-économiques prouvant son efficacité.
- Il permet à un industriel d’obtenir un financement de sa technologie afin de favoriser la mise en œuvre de l’étude pivot qui permettra d’établir son utilité.
- Il conjugue en effet la mise à disposition précoce pour les patients d’une technologie de santé et le recueil des données cliniques ou médico-économiques nécessaires à démontrer son intérêt en vue de sa prise en charge financière pérenne.
Ce dispositif s'adresse-t-il à mon projet ?
Destiné aux technologies à fort enjeu clinique ou économique, l’entrée dans le dispositif du forfait innovation constitue une voie privilégiée d’accès au marché.
- Une technologie qui entre dans le forfait innovation est diffusée sur le marché français via l’inclusion de patients dans l’étude avec la possibilité d’une prise en charge de patients supplémentaires entre la fin des inclusions et la prise en charge de droit commun afin d’assurer la continuité de la prise en charge de la technologie entre l’étude clinique et la prise en charge de droit commun.
Le forfait innovation est accordé par les ministres chargés de la Santé et de la Sécurité sociale qui examinent les aspects budgétaires, après avis de la HAS qui a pour rôle d’établir l’éligibilité de la demande au regard : du caractère innovant de la technologie et de la pertinence de l’étude proposée.
Type de financement
- Prise en charge dérogatoire et temporaire de la technologie et des soins associés à son utilisation : pour les patients de l’étude et pour une cohorte additionnelle afin d’éviter une rupture d’accès jusqu’à la prise en charge de droit commun ;
- Coût de l’étude clinique à la charge du promoteur.
Montant du financement
Le forfait alloué est versé à l’établissement à chaque patient inclus dans l’étude. Il prend en compte la technologie mais également les coûts de soins qui lui sont associés.
Son montant est défini pour chaque technologie éligible après analyse du budget prévisionnel établi par le demandeur selon le modèle défini par le ministère. La prise en charge peut être, selon la technologie, partielle ou totale.
Pour plus d’information, consultez le site de la DGOS.
Calendrier / périodicité
Accès permanent. L’entreprise dépose sa demande lorsqu’elle est prête à le faire, au regard de la maturité de sa technologie, des premières données disponibles et lorsque le protocole de l’étude pivot qui motive sa demande est établi.
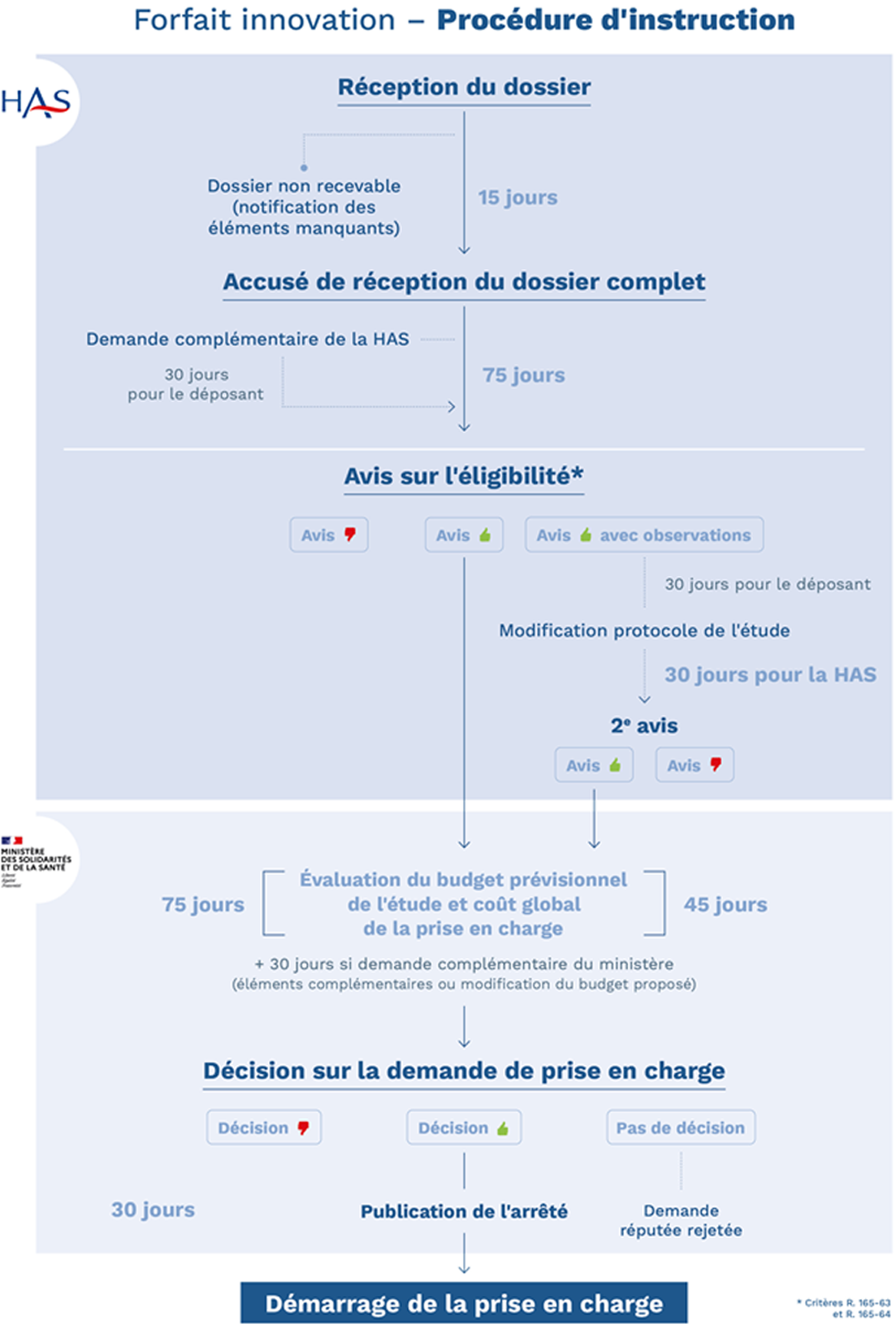
Les délais de réponses sont contraints par des délais réglementaires pour chaque étape. Les délais sont désormais plafonnés à 75 jours pour les deux acteurs chargés d’instruire les dossiers, la HAS comme le ministère, chargé pour sa part d’évaluer le budget prévisionnel de l’étude et de se prononcer sur le coût global de la prise en charge envisagée.
Type de porteur
- Un distributeur, un fabricant de produits de santé innovants (dispositif médical, dispositif médical de diagnostic in vivo) ;
- Un conseil national professionnel (CNP) dans le cadre d’un acte professionnel ;
- En association le cas échéant avec une entreprise assurant une prestation de service ou avec un établissement de santé.
Maturité du projet
Vous devez avoir déjà construit le protocole de l’étude qui permettra de collecter les données nécessaires à la prise en charge de droit commun. Ce protocole fait partie du dossier à déposer.
Conditions à remplir
Les technologies innovantes concernées sont celles qui disposent, au moment du dépôt de dossier, de données établissant qu’elles sont susceptibles d’apporter un bénéfice important pour la santé ou de réduire les dépenses de santé mais qui ne sont pas suffisantes pour revendiquer une prise en charge par la collectivité selon les règles de droit commun.
En bref, l’éligibilité d’une demande de prise en charge dérogatoire est appréciée par la HAS au regard de critères cumulatifs de trois ordres :
- le type de technologie concernée au regard des catégories de technologies de santé éligibles au forfait innovation, à savoir dispositifs médicaux (DM), dispositifs médicaux de diagnostic in vitro (DM-DIV), actes professionnels ;
- le caractère innovant de la technologie (4 conditions définies à l’article R.165-63 du code de la sécurité sociale) ;
- la pertinence de l’étude clinique ou médico-économique proposée par le demandeur (conditions définies à l’article R.165-63 du code de la sécurité sociale).
Comment se porter candidat ?
Les dossiers de demande de prise en charge doivent être transmis simultanément à la DGOS (Ministère des Solidarités et de la Santé) et à la HAS.
Un guide décrivant le dossier à déposer et les modalités pratiques de dépôt est à votre disposition pour vous aider dans vos démarches.
Questions fréquentes
En savoir plus
Pour plus d'information, consultez :
La DGOS propose également des rendez-vous, en amont du dépôt de dossier pour échanger sur le cadre général, le fonctionnement des dispositifs de soutien à l’innovation et l’interaction avec d’autres outils de financements.
La HAS propose pour les industriels qu'ils le souhaitent des rendez-vous (gratuits et confidentiels) avant le dépôt du dossier :



